לאדם ולגרגר אורז יש מספר גנים די דומה - כ-30-45 אלף גנים בעלי תפקיד ברור באדם, ו-32-55 אלף באורז. ובכל זאת, אדם הוא יצור מורכב ומתוחכם, פאר הבריאה, בעוד שאורז - הוא בסך הכול אורז. פרופ' שולמית מיכאלי, סגנית נשיא למחקר באוניברסיטת בר-אילן וחוקרת בולטת בתחום ביטוי גנים, מרגיעה: אנחנו אכן מורכבים יותר מאורז. הסיבה לכך היא מנגנון ביולוגי המאפשר לנו לנצל אותו מספר גנים באופן הרבה יותר מוצלח.
למעשה, אחד המנגנונים החשובים שמסביר את המורכבות שלנו התגלה רק בסוף המאה ה-20 ותחילת שנות ה-2000, עם פענוח הגנום האנושי, והיה מדובר בשינוי תפיסתי של ממש. אם בשיעורי הביולוגיה למדנו שגנים הם "התוכנית האדריכלית" של הגוף, וחלבונים הם אבני הבניין ומנגנוני הבקרה שלו, עכשיו מתברר שהתוכנית האדריכלית הזאת מודולרית מאוד וגנים חדשים נוצרים כל הזמן, באמצעות "קבלני הבניין" - מולקולות ה-RNA. הן אלה שמתרגמות את התוכנית האדריכלית למציאות בשטח.
שחבור חליפי
מותר האדם מן האורז
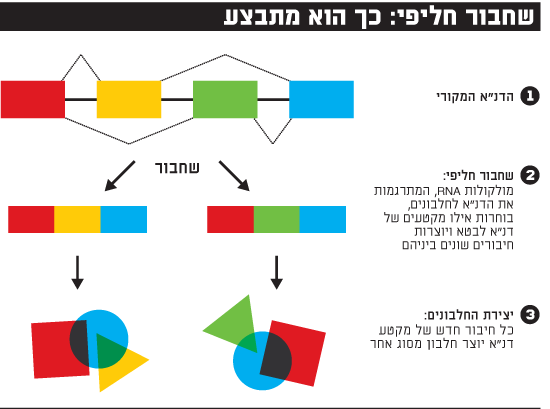
עד שנת 2000, כשפוענח הגנום, הנחת היסוד הייתה שכל גן של דנ"א מקודד חלבון אחד ויחיד, כלומר אם נניח שגוף האדם הוא שכונה, הרי שכל גן הוא תוכנית לבניין אחד. אבל אז נתקל המדע בבעיה: התגלו כ-20 אלף גנים המקודדים חלבונים, אבל יותר מ-90 אלף חלבונים שונים! נראה, אמרו החוקרים, שמשהו קורה בגוף שמאפשר לתוכנית אדריכלית אחת לייצר שני בניינים שונים לגמרי, לפחות.
הבעיה הזאת צצה בתחילת שנות ה-2000, כאשר מעט מאוד היה ידוע על מבנה הגנום ועל האופן שבו מתורגמים הגנים לחלבונים. אולם כבר אז החל להסתמן הפתרון: מנגנון שחבור חליפי. פרופ' שולמית מיכאלי, היום סגנית הנשיא למחקר באוניברסיטת בר-אילן, הייתה אחת החוקרות המובילות שעסקו בפענוח המנגנון.
מיכאלי מבקשת מאיתנו לדמיין שהתוכנית האדריכלית שלנו היא מודולרית. כלומר, לפעמים בונים את כל הבניין, לפעמים בונים רק את קומת הגן והגג ומחברים אותן זו לזו בלי קומות האמצע, לפעמים בונים רק את קומת הגן ללא יתר הקומות. לפעמים בונים רק את הקומות 2-5. כך, מאותה תוכנית גנטית יוצאים בניינים (חלבונים) שונים מאוד.
"ככל שבעל החיים מורכב יותר, כך סביר יותר שהוא משתמש בגנים שלו באופן יצירתי יותר, וכך הוא הגיע למורכבות הזאת", אומרת מיכאלי.
כך, בעוד שאורז מייצר חלבונים הומוגניים יחסית מכל גן, בני אדם מייצרים ממנו מגוון גדול של חלבונים. מה זה אומר לגבי בני אדם? למשל, שבבלוטת התירואיד גן מסוים מקודד חלבון לתירואיד, ואילו במוח אותו גן מקודד פקטור גדילה. אותם גנים, אותה תוכנית בסיס, אבל היא יודעת לייצר גם מוח וגם תירואיד. לא פלא שאנחנו לא אורז. כך גם אפשר להסביר מדוע אנחנו כל כך דומים גנטית לעכברים או לתירס (כן, אלה כמעט אותם גנים), אבל כל כך שונים. בבני אדם, בערך 70% מהגנים יכולים לעבור שחבור חליפי. התופעה שהתגלתה בסוף המאה ה-20, אולם בהדרגה התבררו היקפה וחלקה המהותי בגנטיקה האנושית.
למרבה הצער, מלבד תרומתו של התהליך למורכבות שלנו כבני אדם, השחבור החליפי אחראי כנראה לרבים מסוגי הסרטן. "אותו גן יכול בשחבור מסוים לקודד חלבון שגורם לתא למות, ובשחבור אחר לקודד חלבון שאומר לו דווקא להתרבות", אומרת מיכאלי. בדרך כלל, הגוף מנהל את התהליך כך שתאים מתים או חיים בדיוק בזמן הנחוץ. "אם המנגנון הזה משתבש, תאים שצריכים למות ימשיכו לחיות ולהתרבות למרות שהגוף היה אמור לזהות אותם כבעייתיים".
בשנים האחרונות, מתברר ששחבור חליפי הוא לא סוף פסוק במורכבות של הגוף, והתמונה כנראה עוד הרבה יותר מורכבת ורבגונית. דמיינו למשל תוכנית אדריכלית שבה האדריכל כתב לעצמו כמה הערות בצד, אבל הן לא חלק מהשרטוט של הבניין. או שכן? בכל גן ישנם מקטעי "שקטים" שלא אמורים לעבור תרגום לחלבונים. אולם, לפעמים הגוף מחליט לתרגם מקטע שבעבר לא תורגם. המשחק הזה מוסיף עוד יותר למורכבות ומאפשר לייצר עוד המון חלבונים מכל גן ומעשיר את השפה שבה כתובה תוכנית הגוף.
זו למעשה "אבולוציה מאוחרת" של אדם בעודו חי. ברגע מסוים, התוכנית הגנטית שלו מכילה מידע מסוים, וברגע הבא יש בה עוד אפשרויות שלא היו בה קודם לכן.
"תהליך ההתפתחות של הגנים קורה כל הזמן", אומרת מיכאלי. "כל הזמן נוצרים גנים חדשים בעקבות הפיכת גנים לא מקודדים למקודדים". הרכיבים בגן שלרוב אינם מקודדים ולפעמים פתאום כן, נקראים אינטרונים. מספרם אצל בני האדם הוא הגבוה ביותר מכל היצורים החיים, וזה מעלה שאלות משמעותיות על תפקידם בהתפתחותנו".
עדיין לא הכול ידוע, אך משערים שהשחבור החליפי מאפשר התאמה מהירה יותר לסביבה חדשה, מכפי שהיה מתאפשר לו היינו סומכים רק על מוטציות חדשות בגנום המקורי, שנולדנו איתו. כלומר, בני האדם נמצאים היום, כל הזמן, באבולוציה מהירה יחסית.
בתנאים של עקה לגוף - חום, רעב, צמא, אפילו לחץ נפשי - משתנה סביבת החלבונים בתא ומאותתת לשחבור חליפי להתרחש. התוצאה היא ממש כמעט כאילו הפכנו לאנשים אחרים מבחינה גנטית.
"אנחנו מתחילים להבין שכמעט אי-אפשר לחקור שום מנגנון בגוף כתהליך עצמאי ונפרד. כמעט כל תהליך בגוף תלוי בכל תהליך אחר בגוף, וחייבים לחקור אותם יחד - כל הגנום, כל הטרנסקריפטום (מולקולות ה-RNA) וכל הפרוטאום (החלבונים)", אומרת מיכאלי.
להרוג את הלישמניה
מיכאלי חוקרת את מנגנון השחבור החליפי דווקא לא באדם אלא בטפיל הלישמניה, שגורם למחלת העור שושנת יריחו. טפיל זה, המתרבה באזורים מדבריים, הולך ומתפשט בשנים האחרונות מאזורים מרוחקים לעבר מקומות יישוב, בעקבות התפשטות אוכלוסיית שפני הסלע, נשאים של המחלה. לישמניה גורמת נגעים כואבים מאוד בעור וצלקות, ואצל אנשים עם מערכת חיסון פגועה, היא עשויה אף להיות קטלנית.
במסגרת המחקר שלה, גילתה מיכאלי מורכבות נוספת של השפה הגנטית: היא מצאה שייתכן חיבור בין שני חלקים שמקורם אינו באותו גן, דבר המגביר לאין ערוך את החיבורים האפשריים. אם נחזור לדימוי השכונה, הדבר דומה לבניית בניינים המורכבים מתוכניות אדריכליות שונות: הגג מתוכנית אחת והמחסן מתוכנית אחרת. דמיינו כמה בניינים שונים אפשר לבנות מאותו "פול" של תוכניות - הגנום על 20 אלף הגנים המקודדים שלו.
"הלישמניה צריכה לשרוד בתנאים שונים. בתחילת חייה היא נמצאת בזבובים בעלי דם קר ואחר כך בבני אדם או במכרסם בעלי דם חם, ולכן היא צריכה להיות מאוד גמישה מבחינת החלבונים שהיא מבטאת", מסבירה מיכאלי. "גילינו שתי תופעות ייחודיות בלישמניה - האחת היא שתחת עקה חמצונית (למשל, בעת טיפול בתרופות במחלה שהטפיל יצר), נוצר תהליך של מוות מתוכנן של תאים. הסיגנל שניתן לתא להתחיל בתהליך ההתאבדות, ניתן באמצעות חלבון המופק בעקבות שחבור חליפי של יותר מגן יחיד. המנגנון הזה תואר בכתב העת Science בשער המגזין.
"בתנאי עקה פיזיולוגיים, מתרחש שחבור אחר, שגורם לטפיל שנמצא בסטרס להפריש חומר שמשדר לחברים שלו, 'אל תקחו אותי איתכם'. הטפילים נוהגים לצאת למסע מהמעי של המאכסן אל בלוטות הרוק שלו כדי להעביר את ההדבקה למאכסן חדש. הדרך הזאת היא קשה ומלאת חתחתים, והטפיל הפגוע בעצם אומר לחבריו, השאירו אותי כאן, אל תחכו לי, ממילא לא אוכל לשרוד".
משהו דומה קורה גם בבני אדם?
"לא בדיוק, אך שחבור חליפי אחראי לבקרה של רמות הרצפטור במוח הקולט את המוליך העצבי סרוטונין. לפעמים הגן משתחבר כך שיש הרבה קולטנים לסרוטונין ולפעמים אותו גן יוצר פחות קולטנים לסרוטונין, ויש לכך משמעות בתהליכים שמובילים להתאבדות של בני אדם".
האם השחבור החליפי מקשה עלינו היום במחקר ופיתוח של התרופות?
"כן. למשל בסרטן אנחנו היום מפתחים תרופות למוטציות גנטיות שהתא הסרטני מציג (שינויים בתוכנית האדריכלית עצמה), אבל יכול להיות מצב שבו תא סרטני מפעיל שחבור חלופי למשך זמן מסוים, אף שלא חל בכלל שינוי גנטי באותו תא. נראה כי לפעמים סרטן מתבטא ללא תלות במוטציות חדשות, אלא באמצעות שינויים בשחבור".
על בסיס ההבנה העמוקה של המנגנון הפועל בלישמניה, פיתחה מיכאלי תרופה נגד הטפיל בשיתוף עם פרופ' ז'ון פאול (משה) ללוש מהמחלקה לכימיה באוניברסיטה. "יצרנו חלקיקי ננו שהורגים את הטפילים אחרי 20 דקות. הראינו שהחלקיקים הללו יכולים להגן מפני לישמניה בתוך הגוף, ואנחנו בוחנים את התרופה גם כמשחה הנמרחת על לישמניה עורית".
מתקפה משולבת
ההתמקצעות של מיכאלי בתחום הננוטכנולוגיה בתרופות, יחד עם הידע שלה בגנטיקה, הובילו אותה למחקר בתחום של השתקת גנים באמצעות ננו-נשאים, שגם בו היא משתפת פעולה עם ללוש, ולחקר של מודיפיקציות של ה-RNA בסרטן הדם. "אנחנו מאמינים שהשינויים הללו נותנים לחלק מהתאים הסרטניים עדיפות", היא אומרת.
איך מתמודדים עם תהליכים מורכבים כל כך כשמפתחים תרופות?
"זה מלמד אותנו שתרופה יחידה לא תפעל כנראה בהצלחה במקרה של מחלות שמבוססות על מנגנונים מורכבים. יש לתקוף בבת אחת כמה מנגנונים, כי סביר שגם הטפיל או התא הסרטני מפעילים מגוון מנגנונים ועוברים מגוון של אדפטציות כדי לשרוד".
מהפכת המדעים של אוניברסיטת בר-אילן: "הכוונה שלנו היא לייצר מדע שאינו יכול להתקיים ללא שיתופי פעולה בין-תחומיים"
פרופ' שולמית מיכאלי הוכשרה במכון ויצמן ועברה לאוניברסיטת בר-אילן בתחילת שנות ה-2000. ב-2017 היא מונתה לסגנית נשיא למחקר. לפני כן הייתה באקדמיה הלאומית למדעים. "החזון שלנו לשנים הקרובות באוניברסיטה הוא פיתוח מואץ של תחום ה-STEM (Science, Technology, Engineering, Math, או בקיצור, התחומים ה"ריאליים"). כיום יש באוניברסיטה יחס גדול יותר מאוניברסיטאות אחרות של מדענים בתחום העיוני לעומת התחום הניסויי. אנחנו מנסים למשוך חוקרים במדעים המדויקים, מדעי החיים, הנדסה ורפואה ומדעי המוח, בלי לפגוע בתחומים הקיימים. אנחנו עושים הרבה כדי לספק את הצרכים של מדענים נקלטים ולאפשר להם לקיים קבוצות מחקר בתחומים שבחרנו להצטיין בהם".
מה הוביל להחלטה הזו?
"אחרת קשה לאוניברסיטה לשגשג. מודל תקצוב האוניברסיטאות נותן דולר מול דולר על כל מענק מחקר, והמענקים בתחום ה-STEM גדולים יותר. הסטטוס של אוניברסיטה נקבע במידה רבה על בסיס ה-STEM. כל מדדי האוניברסיטאות, כמו שנחאי והתיימז, מושפעים מהתחומים הללו. אנחנו גם רוצים להתאים את עצמנו לצרכים של המדינה, שזקוקה לכוח אדם מוכשר בתחומים האלה.
"אני הגעתי לאוניברסיטה בתחילת שנות ה-2000, לגל הראשון של הגשמת החזון הזה - פתיחת בית הספר להנדסה, ואחר כך הקמת בית הספר לרפואה בצפת שנמצא במגמת הרחבה. היום אנחנו פותחים תוכניות בין-תחומיות חדשות, ובעיניי זה העתיד. כדיקאן החוג לביולוגיה פתחתי מגמות משולבות לפסיכולוגיה וביולוגיה, ביולוגיה וסביבה, ביולוגיה וכימיה".
איך אתם בוחרים את התחומים שבהם אתם פועלים?
"מדובר בשילוב של מצוינות המדען שאפשר לגייס יחד עם סימון תחומים שנראים כתחומי העתיד, למשל מחשוב קוואנטי, ביג דאטה, רפואה מותאמת אישית. פתחנו עכשיו מרכז רפואה מותאמת אישית עם 50 חוקרים מדיסציפלינות שונות מהאוניברסיטה, כולל מתחומי החינוך והפסיכולוגיה והעבודה הסוציאלית. כשמתאימים תרופות באופן אישי, גם הגשת הרפואה צריכה להיות אישית. אם המטופל לא ייבדק או לא ייטול את התרופה, מה משמעות העובדה שיש כזו בדיקה או שיש תרופה? הכוונה שלנו היא לייצר מדע שאינו יכול להתקיים ללא שיתופי פעולה כאלה".
איך השינוי הזה משפיע על התרבות הארגונית באוניברסיטה?
"יש אווירה של חלוציות ושל בנייה והתפתחות. כל אחד מהחוקרים החדשים שלנו הוא אדם שרוצה להיות גורם משמעותי בצמיחה של דבר שעדיין לא קיים. למשל קלטנו עכשיו את האסטרופיזיקאי הראשון. הוא לא אחד מכמה".
האם הדגש על STEM מפחית את הדגש באוניברסיטה על יהדות?
"לא. זה בדנ"א שלנו. היהדות חייבת להתבטא בכל המחלקות. אנחנו עושים מאמץ גדול להנגיש את היהדות בת-זמננו לכל החוקרים ולהפוך את בר-אילן למקום תוסס ועכשווי, לשאול שאלות ביהדות. אנחנו לא מפחדים משאלות כמו 'היהדות לאן'. להיפך, אנחנו רוצים להיות המקום הזה.
"אני מעורבת היום בפיתוח תוכנית חדשנית שנקודת המבט שלה היא איך התנ"ך השפיע על האנושות, על הציונות, על המוזיקה, על האמנות, איך הוא השפיע על מיכלאנג'לו. אנחנו מפתחים מרכז מחקר על התנ"ך".
ואיך ביולוג או חוקר חומרים משתלבים בזה?
"אנחנו בוחנים, למשל, איך האתיקה היהודית מתייחסת לעריכה גנטית".
בעקבות הפעילות שלך באקדמיה הלאומית למדעים, מהם התחומים החזקים של ישראל כולה בסקטור הביולוגיה?
"ביואינפורמטיקה, נוירוביולוגיה, מיקרוביולוגיה, אימונולוגיה ושילובים מעניינים מאוד, למשל בין מדעי החיים לרפואה וארכיאולוגיה רפואית ועד רפואה מותאמת אישית לאוכלוסיות מיוחדות. נכנסתי לאקדמיה הלאומית עם הערכה רבה ויצאתי עם הערכה עוד יותר רבה. יש שם צוות מסור שלא ראיתי כדוגמתו. מהמנכ"ל ועד אחרון האנשים".
ת"ז: פרופ' שולמית מיכאלי
גיל: 62
תפקיד: סגנית נשיא למחקר באוניברסיטת בר-אילן
חוקרת: תהליכי ביטוי גנים בבני אדם ובטפילים. התרומה הייחודית שלה למחקר מנגנון השחבור החליפי היא הגילוי שהתהליך התרחש גם ביצורים קדומים
השכלה: תואר ראשון ודוקטורט במסלול ישיר מהמחלקה למיקרוביולוגיה באוניברסיטת תל-אביב
מצב משפחתי: נשואה פלוס שלושה
תחביב: גידול ירקות בגינת ירק
שחבור חליפי (Alternative Splicing)
- מה זה? תהליך המאפשר למעט גנים יחסית ליצור את כל המורכבות של הגוף האנושי ואת היכולת שלו להשתנות בתנאים שונים לאורך השנים
- איך זה קורה? אם בעבר חשבנו שכל גן יוצר חלבון אחד, כמו שכל תוכנית אדריכלית יוצרת בניין אחד, מתברר שהגנים הם מודולריים. בכל פעם חלקים שונים בהם מתחברים באופן אחר
- איך הגוף מחליט איך מחברים את הבניין כרגע? לפי שדרים מהגוף עצמו ומהסביבה
- מה המשמעות של כל זה? השחבור החליפי מסביר כיצד אנחנו יכולים להיות כל כך ורסטיליים ומורכבים, ולעבור "מיני אבולוציה" במהלך חיינו, ולא רק בין דורות
- האם התהליך ייחודי לאדם? לא, אך הוא הרבה יותר מפותח באדם מאשר בחיות אחרות