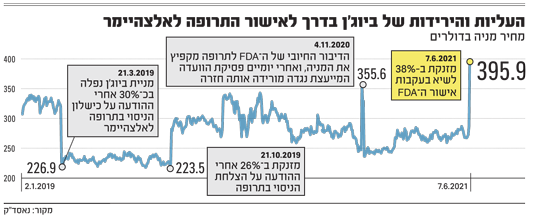
מינהל המזון והתרופות האמריקאי (FDA) החליט לאשר את התרופה של חברת ביוג'ן (Biogen) לטיפול באלצהיימר אחרי תהפוכות רבות שעברה החברה עם המוצר וכשברקע מחלוקות בשאלה אם אכן הוא ראוי לאישור. ראיה לחוסר הוודאות שאפפה את האישור הלא-מובן מאליו הזה היא העובדה שההחלטה החיבוית לא הייתה מתומחרת בשווי של ביוג'ן, שמנייתה עלתה ב-38% לאחר פרסום האישור ונסחרת כעת לפי שווי של 59 מיליארד דולר.
ה-FDA, נזכיר, החליט לאשר את התרופה למרות שחברי הוועדה המייעצת שכינס הצביעו כמעט פה אחד נגד. המוצר אושר במסלול המקוצר של ה-FDA, המיועד למוצרים שעדיין צריכים לעבור ניסויים נוספים. האם מדובר באמת בבשורה יוצאת דופן לחולי אלצהיימר? ומדוע ההחלטה נחשבת כל כך דרמטית, לא רק בתחום הטיפול באלצהיימר אלא גם לתרופות אחרות? גלובס עושה סדר.
על מה היה הוויכוח בין ה-FDA לוועדה המייעצת?
התרופה של ביוג'ן, ששמה אדוקנומב, עברה בהצלחה ניסוי קליני קטן, שהיה מוצלח מספיק כדי שה-FDA יאשר לחברה לדלג על שלב II של הניסויים הקליניים (ניסויי יעילות בכמה עשרות עד מאות אנשים) ולגשת ישירות לניסוי שלב III, ממש כפי שעשתה בחיסונים לקורונה. עם זאת, החברה התבקשה לצאת לשני ניסויים במקביל כדי שכל אחד מהם יאשש את השני - הליך מקובל יחסית. הניסויים החלו ב-2016, ובינתיים המשיכו להתפרסם תוצאות ארוכות טווח טובות מהניסוי הראשון, הקטן.
ב-2019 הוכה השוק בתדהמה כאשר ביוג'ן הודיעה שהחליטה להפסיק את הניסויים כי נראה היה שלא יעמדו ביעדיהם העיקריים. ביוג'ן החליטה להסיר את התרופה מתוכנית הפיתוח שלה. אלא שכעבור כמה חודשים הוכה השוק בתדהמה גדולה אף יותר כאשר החברה הודיעה שהיא ניתחה את התוצאות בדיעבד ומצאה שבאחד הניסויים ובאחד המינונים התוצאות היו טובות. על הרקע הזה החליטה ביוג'ן, בצעד חריג מאוד, להגיש את המוצר לאישור ללא ניסוי נוסף. אי-אפשר היה אפילו לחזור ולהשלים עד סופם את הניסויים המקוריים שהופסקו.
ועדה של מומחים בתחום הנוירולוגיה שכינס ה-FDA קבעה שהתוצאות אינן מעידות באופן חד-משמעי על שיפור קוגניטיבי, גם בניתוח החדש, משום שניתוחים בדיעבד הם "כמו לירות את החץ ואז לסמן סביבו את המטרה". עשרה מומחים הצביעו נגד אישור המוצר. אחד נמנע. זה קרה בסוף 2020.
כעת, ה-FDA הודיע שהוא מאשר את המוצר באישור חירום מהיר. הנימוק היה שאם ביוג'ן תישלח לבצע ניסוי נוסף לפני אישור, תוצאותיו עשויות להגיע רק בעוד 4-5 שנים, וזה מאוחר מדי לחולים. עדיף לאשר את המוצר, על בסיס האפשרות הסבירה (בעיני ה-FDA) שהוא יעיל, כדי שיהיה נגיש למי שמעוניין לצרוך מוצר שאושר בתנאים כאלה. במקביל, יש להמשיך לחקור את הדברים בשטח.
מדוע במשך 20 שנה לא נרשמה תרופה חדשה לאלצהיימר?
קודם כול, זה לא עניין חריג. קשה מאוד לפתח תרופות, ויש מחלות רבות שבהן ההתקדמות נעצרת למשך עשרות שנים, משום שאין תובנות חדשות משמעותיות לגבי המנגנון הביולוגי שעומד בבסיסן. המדע פועל בקפיצות, ולפעמים אחרי תקופת יובש כזו פתאום מגיעה פריצת הדרך.
בניסיונות לפתח תרופות לאלצהיימר הושקע הון. כמה וכמה חברות ענק ניסו לפתח לאורך השנים תרופות למחלה הזאת. כולן נכשלו. אלצהיימר היא מחלה קשה לאבחון, ועד שמבינים מה מתרחש, הנזק המוחי משמעותי וקשה מאוד להתערב בו.
רבות מהתרופות שפותחו לטיפול במחלת האלצהיימר פעלו כדי לפרק מצבורים של חלבונים בשם עמילואיד ביטא (מה שמכונה "פלאק"), המופיעים במוח של החולים הללו באופן חריג, שאינו מתרחש בדמנציה מסוגים אחרים. כל תרופה התערבה בשלב אחר של המנגנון הזה וניסתה לתקוף את הצטברויות החלבון בדרך שונה.
ההיגיון הוא שאם מצטברים חלבונים כאלה במוח, הסילוק שלהם אמור לשפר את מצב המחלה. אבל אף תרופה שפותחה על בסיס המנגנון הזה לא באמת הצליחה להוכיח את יעילותה בניסויים קליניים גדולים, ולכן יש גם חוקרים שחושבים שפירוק העמילואיד ביטא אינו הדרך להילחם במחלה. אולי החלבון הוא תוצר לוואי של מנגנון הנזק של המחלה? אולי הוא בכלל מנגנון הגנה?

מנכ"ל ביוג'ן, מישל וונטסוס / צילום: מתוך אתר החברה
גישה אחרת אומרת שהטיפול בעמילואיד ביטא הוא כן הדרך הנכונה, אלא שהניסויים שנערכו עד כה לא היו טובים מספיק כדי להראות זאת. שאלוני הערכת התפקוד לא רגישים מספיק. בטווח הזמן הארוך הדרוש להוכיח האטה בהידרדרות, מאבדים נבדקים שמתו בינתיים, או שנשרו מהניסוי או שהתרחשו אירועים אחרים שהשפיעו על מצבם.
ה-FDA התגלה בחוות הדעת שלו כתומך נלהב בתיאוריית הפלאק. הוא הצהיר שהעובדה שהתרופה מורידה כמות גדולה של פלאק יחסית לתרופות קודמות שנבדקו היא מדד חליפי ראוי למדוד לפיו את התרופה, ומנבאת כי תהיה לה הצלחה להוכיח את יעילותה בשוק. כמו כן, באופן שלא לגמרי מתיישב עם האמירה הקודמת, נטען כי אישור התרופה הוא הוכחה לתיאוריית הפלאק.
יש גם תופעות לוואי לתרופה שאושרה?
כן. כ-40% מהמטופלים פיתחו דלקת מוחית שהובילה לכאבי ראש, סחרחורת, הפרעות לראייה, בחילות או הקאות. כ-17%-18% סבלו מדימומים זעירים במוח. לכן התרופה ניתנת בזהירות, במינונים הולכים וגדלים, ולכן ה-FDA הזהיר שכל נבדק יעבור MRI לפני הזריקה הראשונה, השביעית וה-12 של המוצר כדי לראות אם ישנה התנפחות של המוח. אם ההתנפחות לא רבה, אפשר להמשיך בטיפול, אומרים ב-FDA.
לכמה שיפור אפשר לצפות בחולים שהתרופה מתאימה להם?
על פי ביוג'ן, התרופה מאטה את התקדמות המחלה, כלומר, היא לא תחזיר יכולות שאבדו ולא תקבע את המצב הקיים. במינון הגבוה באחד משני הניסויים נמצא הבדל מובהק סטטיסטית בקצב התקדמות המחלה בין קבוצת הטיפול לקבוצת הביקורת. הרופאים חלוקים בשאלה אם ההבדל הזה משמעותי ברמה הקלינית, כלומר האם מדובר בהשפעה מהותית על איכות החיים של המטופל. חלק מהרופאים שמטופליהם השתתפו בניסוי דיווחו שנראה כי התרופה מאטה מאוד את המחלה בחלק מהחולים (אפקט שיכול להיות ממוסך על ידי הנתון הממוצע בכלל משתתפי הניסוי). אולם קשה לדעת אם זו באמת ההשפעה של התרופה או של גורמים אחרים בחיי החולה.
איך ישפיע אישור ה-FDA על אישורן של תרופות אחרות?
ההחלטה היא תקדימית בשני מובנים. ראשית, ה-FDA למעשה פסק בניגוד לעמדת הוועדה המייעצת שלו. החלטה כזאת מעלה סימני שאלה בציבור, בקרב רופאים, מטופלים ומשקיפים מהצד. אולם כפי שהוסבר בהודעת ה-FDA, מדובר בשינוי גישה כולל של הרשות - לאשר מוצרים במהירות על פי סמנים ביולוגיים (במקרה זה, העמילואיד) ולא תמיד על בסיס סמנים קליניים שלוקח הרבה יותר זמן לאסוף (למשל הציון בשאלון התסמינים), ואז לראות את ההתנהגות שלהם בשוק. אם אכן מדובר בשינוי גישה לרוחב ה-FDA, הרי שבשנים הקרובות צפויות להיות מאושרות הרבה יותר תרופות, הרבה יותר מהר מהקצב שהתרגלנו אליו בעבר. זה תהליך שכבר החל, אך החלטה זו מעידה שהוא צפוי להימשך ואף לגבור.
כמה תעלה התרופה ומי ישלם עליה?
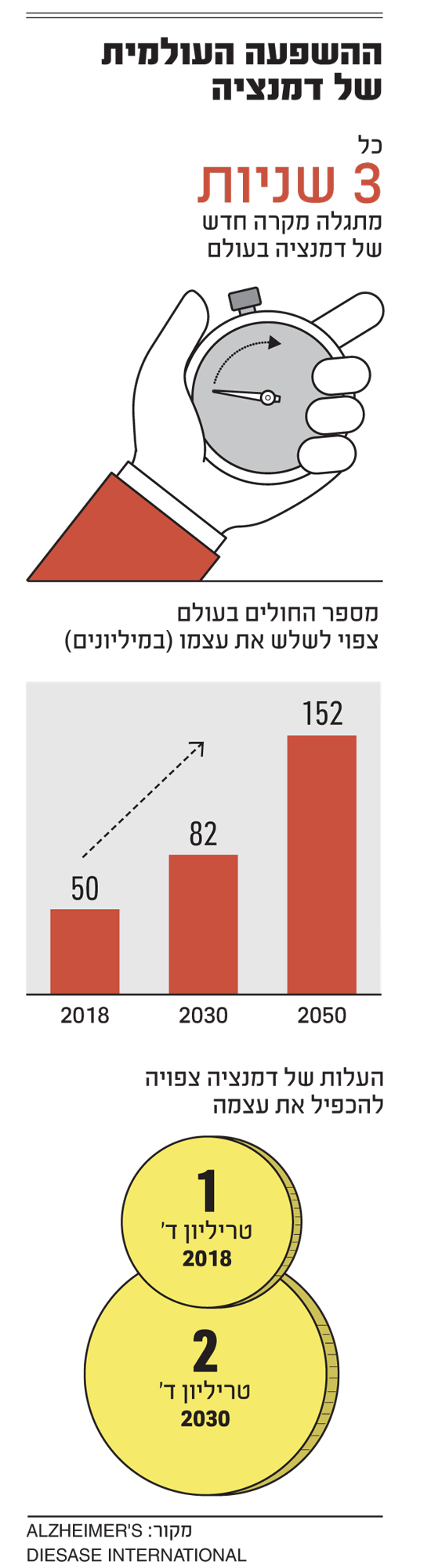
חולי האלצהיימר שטענו לטובת אישור התרופה ציינו שייתכן שהחשש לאשר אותה נובע דווקא ממניעים כלכליים. בארה"ב יש 6 מיליון חולי אלצהיימר, וביוג'ן העריכה כי התרופה יכולה להתאים ל-1.5 מיליון מהם. המחיר שנקבה החברה הוא 56 אלף דולר לטיפול במשך שנה. זה אומר שאנחנו מדברים על - שבו רגע, בבקשה - הוצאה של 84 מיליארד דולר שתמומן על ידי הציבור האמריקאי במסגרת הביטוח הממשלתי מדיקר, לבני 65 ומעלה, שהם 90% מהחולים.
אין באמת ציפייה ש-1.5 מיליון איש יקבלו את הטיפול או שמדיקר באמת ישלם את הסכום הזה, אבל אם התרופה תירשם בהרחבה, היא צפויה לפעור חור משמעותי במימון הבריאות האמריקאי. לכן יש סיכון לא קטן, מבחינת ביוג'ן, שגם אחרי האישור היא לא תצליח לקבל מימון נרחב למוצר, אלא אחרי ניסוי נוסף וחד-משמעי יותר.
רופאים המטפלים בחולי אלצהיימר הביעו דאגה שאם ירשמו להם את הטיפול, ובעיקר אם יבחרו לממן את התרופה מכיסם, זה יהיה על חשבון טיפולים לא תרופתיים שמשפרים את איכות חייהם, כמו קלינאית תקשורת, עזרה בסיעוד ותמיכה נפשית.
מתי התרופה תגיע לארץ?
ביוג'ן מיוצגת בישראל על ידי חברת מדיסון. עד היום, החברה פעלה להביא לישראל תרופות של החברות המיוצגות על ידה במהירות האפשרית, אולם יש גם לקבל את אישור משרד הבריאות. לרוב, משרד הבריאות מאשר כל מוצר שמאושר על ידי ה-FDA , אבל המקרה הזה הוא תקדימי, וייתכן שהוא יעדיף לחכות לניסויים הנוספים.
לתשומת לבכם: מערכת גלובס חותרת לשיח מגוון, ענייני ומכבד בהתאם ל
קוד האתי
המופיע
בדו"ח האמון
לפיו אנו פועלים. ביטויי אלימות, גזענות, הסתה או כל שיח בלתי הולם אחר מסוננים בצורה
אוטומטית ולא יפורסמו באתר.