לפני כמה שבועות כינסנו מנכ"לים של כמה מהסניפים הישראליים של חברות תרופות בינלאומיות מובילות כדי לדון, בין השאר, על תפקידו העתידי של משרד הבריאות. האם הוא יוכל להיות רגולטור ראשוני, כלומר הגוף ששוקל בעצמו את המידע הקיים לגבי תרופה כדי להחליט אם לאשר אותה, או שימשיך לתפקד כחותמת גומי כמעט למוצרים שכבר אושרו במדינות אחרות. המנכ"לים טענו שהתקציב הדל של המשרד יקשה עליו להיות רגולטור ראשוני, ולכן עליו לוותר על הרעיון כליל או להתמקד בתחומים נבחרים. אבל מה חושב על זה משרד הבריאות?
בשבוע שעבר, בכנס זום בנושא "מקומה של ישראל בעולם התרופות והחיסונים", שערך פורום רגולציה כלכלית ותחרות של מכון הורביץ לניהול אסטרטגי, בפקולטה לניהול ע"ש קולר באוניברסיטת תל אביב, הייתה למשרד הבריאות הזדמנות להציג את השקפתו. לצד גורמים בתעשיית הביומד ומערכת הבריאות, השתתפו בכנס פרופ' משה צבירן, דקאן הפקולטה לניהול וראש מכון הורביץ, ויו"ר המכון יאיר סרוסי.
ד"ר אסנת לוקסנבורג, מנהלת טכנולוגיות רפואיות, מידע ומחקר במשרד, דיברה על האופן שבו הקורונה שינתה את אופי עבודתו. נראה שמבחינת המשרד, הקורונה היא הזדמנות לשינוי דרסטי בתפקידו כרגולטור. ראשוני או משני? בעיני לוקסנבורג, השאלה מתחילה הרבה קודם.
"מגוון טכנולוגיות שלא ראינו בעבר"
תקופת הקורונה, אמרה לוקסנבורג, הביאה לשינויים בתפקיד הקלאסי של הרגולטור בכל העולם, ולכן היום המשרד חושב על תפקידו לגמרי מחדש. ניצני השינוי הופיעו עוד לפני המגפה, כחלק ממגמות רחבות יותר שעוברות על משרד הבריאות ועל מקביליו בעולם. "הפיתוח והמו"פ מהירים יותר, ומגיעות אלינו הרבה יותר טכנולוגיות, והן שונות ומגוונות לעומת מה שהכרנו. אנחנו רואים מוצרים שמשלבים בין ביולוגיה והנדסה בצורות חדשות, מוצרים עם שיטות ייצור חדשות, טיפולים מותאמים אישית, טיפולים שבעצמם מיוצרים מתאים של החולה עצמו בתוך בית החולים. משרד הבריאות צריך לתת מענה לסיטואציות האלה ולהבטיח שהמוצרים עדיין בטוחים".
לדבריה, רגולטורים בכל העולם מאמצים גישות שונות לנושא. לדוגמה, ב-FDA בארה"ב וב-EMA באירופה פתחו מסלולי אישור מהירים מיוחדים או שנותנים אישורים מוגבלים על תנאי, עד שמגיע מידע נוסף מהעולם האמיתי. "אבל אלה היו מסלולים בתוך הגישה הקלאסית", אומרת לוקסנבורג. "כשהגיעה הקורונה, השינויים האלה הואצו עוד יותר".
בישראל, קשה ליצור מסלולי אישור מואצים עוד יותר, במשרד שמתקשה ממילא לעמוד בקצב של הרגולטורים הגדולים ומואשם לעתים קרובות בעיכוב האישור של טכנולוגיות, מעבר למה שמובטח בחוק, בגלל מחסור בכוח אדם.
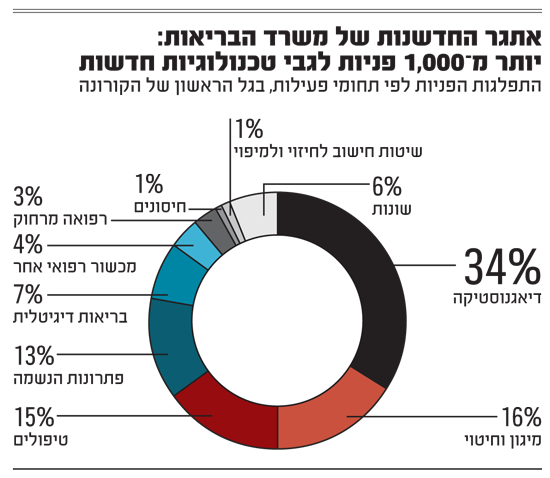
לוקסנבורג סיפרה שבגל הקורונה הראשון הוצף משרד הבריאות בהצעות לחידושים ופתרונות. "קיבלנו בתוך שבועות בודדים 1,000 פניות מגורמים שונים. לכל אחד היה פתרון - אם באבחון, אם בטיפול, אם בפתרון הנשמה".
"למדנו לבצע ניסויים וירטואליים"
המשרד היה צריך להחליט במהירות אילו טכנולוגיות לקדם וכיצד. בהעדר ניסיון בסוג כזה של עבודת תעדוף, לוקסנבורג פנתה לגוף שעבודתו הכי קרובה לכך: הצוות המכין את הדוחות לקראת דיוני סל התרופות. "הם עשו עבודה מדהימה של תעדוף התועלות של הטכנולוגיות שהוצעו לנו מול מיפוי של מה השוק צריך, ועם אילו שותפים אפשר לעבוד כדי לקדם את הטכנולוגיות הללו: מפא"ת לפיתוח המוצרים, בתי חולים לניסויים קליניים".
בתקופת הגל הראשון, נוהלו בישראל 5,700 ניסויים קליניים, מתוכם 1,000 עסקו בקורונה. לא היה טריוואלי להמשיך לנהל את הניסויים שנמצאים בעיצומם בלי הפרעה, ועוד להוסיף עליהם ניסויים חדשים בתקופה עמוסה ממילא. כל ניסוי שקודם היה על חשבון ניסויים בתחומים אחרים.

ד''ר אסנת לוקסנבורג, משרד הבריאות / צילום: יונתן בלום
כדי להפחית כמה שאפשר את הנזק שיצרה הקורונה למערך הניסויים הקיים, התייעץ משרד הבריאות עם רגולטורים אחרים, והתווה פרוטוקול לניסויים קליניים שבהם כמה שיותר מהקשר עם החולה נעשה באופן וירטואלי. "עכשיו אנחנו יודעים לעשות ניסויים כך, ואין כוונה ללכת אחורה", אומרת לוקסנבורג.
"איך אנחנו רוצים לאשר חיסונים?"
מהגל השלישי של הקורונה, מספר הטכנולוגיות שהוגשו למשרד הבריאות ירד באופן משמעותי, משום שתשומת הלב עברה לחיסונים. החלטת הממשלה לחסן בחיסון שלישי לפני העולם הובילה לתשומת לב מוגברת למשרד הבריאות הישראלי, שפיקח על הניסוי, אסף נתונים והציג אותם לרגולטורים אחרים.
בגל הנוכחי, עולות שאלות על האישור העתידי של חיסונים, אומרת לוקסנבורג. "אם החיסון הנוכחי לא עוצר את הגל, אז מה לגבי חיסונים מותאמים לווריאנטים שונים? האם נצטרך לאשר כל התאמה, או שכמו בשפעת, אם אישרנו את החיסון המקורי אנחנו בעצם מאשרים בכך גם אוסף של עדכונים, כל עוד לא נעשה שינוי מלבד ההתאמה הגנטית לווריאנט החדש? ואיך אנחנו מאשרים חיסונים לאוכלוסייה שכבר חוסנה בחיסונים קודמים? האם אנחנו צריכים אישור שונה או המלצה שונה לפי רמת ההתחסנות הקודמת? מה ההשפעה של ערבוב חיסונים? מה רף הוכחת היעילות שיש לדרוש מחיסון חדש כשיש כבר חיסון קיים?". אלה שאלות משמעותיות, ותשובות עדיין אין.
השאלות האלה הובילו את המשרד למחשבות חדשות על תפקידו. הגישה הנוכחית היא מעורבות גדולה יותר בשלבים הראשונים של העבודה עם חברות ישראליות, היכן שניתן להשפיע עם יחסית מעט תקציב וכוח אדם.
"המשרד צריך לעסוק בחיזוי טכנולוגי"
"לישראל אין חברות פארמה גדולות. יש לנו חברות קטנות. זה מכתיב שינויים בתפקיד הקלאסי של משרד הבריאות כרגולטור. במקום רק לאשר מוצרים מוגמרים, אנחנו רוצים להיות מעורבים ולסייע לחברות באופן הרבה יותר אקטיבי, מגיל הרבה יותר צעיר של החברות. אנחנו מפתחים סל של פתרונות יצירתיים ומהירים לקדם טכנולוגיות חדשות".
לשם כך, אומרת לוקסנבורג, משרד הבריאות צריך לעסוק בחיזוי מגמות בעולם הטכנולוגיה. "אנחנו צריכים חיזוי טכנולוגי כדי שנוכל לדעת מול מי אנחנו צריכים לזוז הכי מהר. אנחנו יודעים היום להעריך טכנולוגיות לא בשלות ולעזור לקדם אותן, אחרי שעשינו את זה בגל הראשון של הקורונה.
"זה שינוי דנ"א שעברנו בקורונה ועוד נמשיך לעבור. אנחנו צריכים להיות יותר פרו-אקטיביים, ליזום תהליכים תומכי חדשנות ותומכי חברות. אנחנו צריכים לנצל את היתרון היחסי של ישראל במידע, ליזום ולדחוף בעצמנו שימוש בכלים האלה. ואנחנו צריכים לשמור על שיתופי פעולה בינלאומיים, כדי לדעת מה קורה בתעשיות הבריאות בעולם ולשדר את זה פנימה, לאקוסיסטם הישראלי ולגורמים שונים במדינה".
מה שכבר יש, היא אומרת, הוא רצון של חברות בינלאומיות רבות לעבוד בישראל, לאחר שהקורונה שמה את המדינה על המפה כאתר לניסויים קליניים ובדיקה של טכנולוגיות חדשות. מה שחסר עדיין, הוא תקציב.
"פער בין התוכניות לתקציב"
ד"ר טל מופקדי וד"ר רועי שלם, מנהלי פורום רגולציה כלכלית ותחרות במכון הורביץ, הפקולטה לניהול ע"ש קולר באוניברסיטת ת"א, מסכימים שיש פער בין תוכניות ליכולות תקציביות.
בהרצאה משותפת, הם טענו שהרעיון לעזור לחברות צעירות הוא חיובי, אך הרצון להיות רגולטור ראשוני הוא בעייתי מאוד. בעיקר בתרופות הגנריות כדאי למשרד לאשר באופן כמעט אוטומטי תרופות שאושרו במקומות אחרים. גם כך, הם אומרים, הליך האישור הקיים מעכב את הגעת התרופות לשוק הישראלי אפילו בשנים.
"הליך האישור הכפול מייצר עלות גבוהה יותר לאישור תרופה בישראל, בתועלת זניחה", אומר מופקדי. "יש לשמור את המשאבים של הרגולטור הישראלי לאישור במקומות שבהם יש סיבה טובה לחשוב שיש לו מידע או צורך שאין לאחרים".

חיים הורביץ / צילום: נמרוד גליקמן
משקיע הביומד חיים הורביץ, המנהל את קרן CHealth, סיכם ואמר שישראל צריכה ארבעה מרכיבים עיקריים כדי להיות שחקן משמעותי בפיתוח תרופות ובאישור שלהן: מדע טוב, רגולציה יציבה ותומכת, כישרונות ניהול ומימון. לדבריו, "המחסור העיקרי הוא במימון, כי זה תחום שצורך כמויות אדירות של כסף".
מנהל המכון למחקר ביולוגי: "קיבלנו 173 מיליון שקל לפיתוח החיסון, לעומת מאות מיליונים שקיבלו חברות אחרות"
ד"ר שמואל יצחקי, מנהל המכון למחקר ביולוגי בישראל, סיפר בכנס על פיתוח החיסון הישראלי לקורונה, שנמצא בימים אלה בניסויים קליניים, באמצעות חברת NRX. הטכנולוגיה של החיסון היא הינדוס של חלבון ספייק על גבי וירוס מסוג VSV, שמדבק בעיקר בבהמות. בבני אדם הוא גורם לעתים נדירות מחלה קלה וחולפת. הגישה הזו כבר נמצאת בשימוש בחיסון באבולה.

ד''ר שמואל יצחקי / צילום: יונתן בלום
"השיטה כבר מוכרת ולכן צפינו שהרגולציה תהיה יותר מהירה. הייצור הוא סקלאבילי, והטכנולוגיה מודולרית, כלומר יכולה להתאים גם לווריאנטים חדשים וגם למגפות הבאות, ברגע שנבנה את היכולת", אמר יצחקי.
לפי תוצאות הניסוי הנוכחי, החיסון מנטרל את וריאנט האומיקרון פחות טוב מאשר את הווריאנטים האחרים. "אנחנו רואים ירידה של פי 3 ברמת החיסון, אבל בחיסון של פייזר נצפתה ירידה של פי 8 עד 20", אמר יצחקי. חסר נתון אחד כדי להעריך את משמעות הדבר - מהי מלכתחילה יעילות החיסון של המכון לעומת פייזר. התקווה היא שניסוי שלב II של המכון יניב רמזים לכך בחודשים הקרובים.
זה יהיה כנראה קצת מאוחר מדי לגל האומיקרון, אבל ייתכן שהמשמעות היא שהחיסון יעיל יותר גם בפני וריאנטים אחרים. "קיבלנו עד היום 173 מיליון שקל, והעבודה בוצעה על ידי 80 איש, לעומת מאות המיליונים שקיבלו חברות אחרות", אמר יצחקי ספק בהתפארות ספק בהצטדקות.
יצחקי סיפר מעט על פעילות נוספת של המכון בתקופת הקורונה: בדיקות PCR. "בתחילת המגפה עשינו בעצמנו כ-30% מהבדיקות בישראל, כולל טיפול כמעט בלעדי במערך בתי האבות. פיתחנו נוגדן מאוד יעיל במאי 2020, אך לא ניתן היה לפתח אותו בארץ והיום הוא כבר לא רלוונטי. זו דוגמה לחשיבות שבהקמה של מפעלי חיסונים ומפעלי נוגדנים, וגוף שיכול לנהל ניסויים קליניים במוצרים הללו, וגוף שמתכלל את כל הפעילויות של המדינה בתחום של פיתוח מוצרים רפואיים בעת חירום".
לתשומת לבכם: מערכת גלובס חותרת לשיח מגוון, ענייני ומכבד בהתאם ל
קוד האתי
המופיע
בדו"ח האמון
לפיו אנו פועלים. ביטויי אלימות, גזענות, הסתה או כל שיח בלתי הולם אחר מסוננים בצורה
אוטומטית ולא יפורסמו באתר.