בשנת 2018 קיבל פרופ' מתיו פורתאוס, חוקר מוביל בתחום העריכה הגנטית, טלפון מפתיע. על הקו היה ד"ר הא ג'יאנקוי, מדען סיני שהכיר היכרות שטחית מתקופת לימודיו. הא סיפר לפורתאוס שהוא קיבל אישור מוועדת אתיקה סינית לבצע עריכה גנטית בתינוק בריא באמצעות טכנולוגיית CRISPR לעריכה גנטית. פורתאוס ביקש ממנו שבשום אופן לא יעשה זאת, אך "מתברר שכאשר שוחחנו, זה כבר היה כנראה אחרי המעשה", אומר היום פורתאוס בראיון לגלובס.
● שני סטארט-אפים מנסים להתאושש מהמצב אליו נקלעו, וחברה אחת שמצליחה | השבוע בביומד
● פלורי תפתח בארה"ב טיפול כנגד תסמונת קרינה רדיואקטיבית
זמן לא רב אחרי השיחה הזאת, נעצר הא בסין, אחרי שניסה להפוך שתי תאומות בריאות לגמרי לחסינות בפני איידס באמצעות עריכה גנטית. בתוך כמה ימים מאז שהניסוי שלו נחשף, פרסמו 122 מדענים סינים הודעה המתנערת מהא. הם טענו שהניסוי משוגע, עובר על כללי האתיקה וקטלני לתדמית המדע הסיני בעולם. הא נשלח לשלוש שנות מאסר ושוחרר ב־2022.

ד''ר הא ג'יאנקוי / צילום: Associated Press, Kin Cheung
"הא פנה אליי לאחר שהשתתפתי בוועדה בינלאומית שהייתה אמורה להתוות קווים מנחים לאופן שבו ניתן יהיה יום אחד להתקדם לקראת עריכה גנטית של עוברים", אומר פורתאוס. "ההמלצות המפורשות שלנו היו שהעולם עדיין לא מוכן לעשות זאת, אבל כשדיברתי איתו, הבנתי שהוא סובב את ההמלצה שלי, עיוות את המילים שלי כדי לתת לעצמו גושפנקה לעשות זאת".
פרופ' מתיו פורתאוס
אישי: גדל בקליפורניה. תואר ראשון בהיסטוריה ומדע מהרווארד ותואר ברפואה מסטנפורד
מקצועי: פרופסור לרפואת ילדים, מנהל תחום התרפיה הגנטית והתאית בסטנפורד. נחשב חלוץ בתחום העריכה הגנטית. מהמייסדים המדעיים של חברת CRISPR Therapeutics, שנסחרת בנאסד"ק לפי שווי של 4.3 מיליארד דולר, ושל חברת גרפיט ביו, שאיבדה 85% משווייה בהנפקה
עוד משהו: ניסה להניא את המדען הסיני מלבצע עריכה גנטית בתאומות
הוא היה משוגע, שאפתן, או לא הבין את ההשלכות? היו מדענים, אפילו במערב, שראו בו כמי שהקריב את עצמו למען קידום המדע.
"העולם מלא מדענים שאפתנים, לא פחות ולא יותר ממנו. הוא חשב כנראה שהוא יעשה משהו לטובת האנושות, וגם חיפש תהילה. המערכת לא עצרה ואותו ובכך היא אכזבה את כולנו.
"בתרבות המדעית יש רכיב של סודיות. לא חושפים מחקר מתוכנן של קולגה אם הוא ביקש להתייעץ איתנו בדיסקרטיות. אני מצטער שלא ביקשתי ממנו רשות לשוחח על הנושא עם קולגות, כדי לוודא שישימו עליו עין. אני בטוח שכמו שהוא דיבר איתי, אדם שהוא בקושי פגש לפני כן, הוא דיבר עם אחרים, וכולנו כנראה נפלנו באותו פח. כשהתברר שהוא אכן הלך ועשה את זה, למרות ההמלצה המפורשת שלי, הייתי בהלם ממש כמו כל שאר השחקנים בתחום".
מה עלה בגורל התאומות?
"התאומות, וכנראה ילדה אחת נוספת שעברה אותו טיפול, נעלמו מהרדאר של הקהילה המדעית. יש כאן דילמה אתית רצינית. מצד אחד הן אוצרות אצלן מידע קריטי לתחום - אם משהו השתבש, עדיף שנדע זאת לפני שיבוצעו ניסויים כאלה בילדים נוספים, ואם דבר לא השתבש, גם זה מידע חשוב שיכול להאיץ את הגעתם לשוק של פיתוחים מצילי חיים, אבל מול הרצון שלנו לדעת את כל זה, מגיע להן לשמור על פרטיותן. הדבר האחרון שמגיע להן הוא שיבוצעו בהן עוד הליכים רפואיים לא נחוצים. הייתי רוצה שממשלת סין תמנה איש קשר שיעקוב אחרי בריאותן בלי לחשוף אותן לעולם. אני חושב שסין מנהלת את העניין הזה בסודיות רבה מדי. הם היו מאוד רוצים שהפאדיחה הזאת תיעלם. לצערי אין היום מספיק חסמים שימנעו ממישהו לעשות את השטות הזאת שוב".
הבעיה הגדולה: להפוך את המוסרי לכלכלי
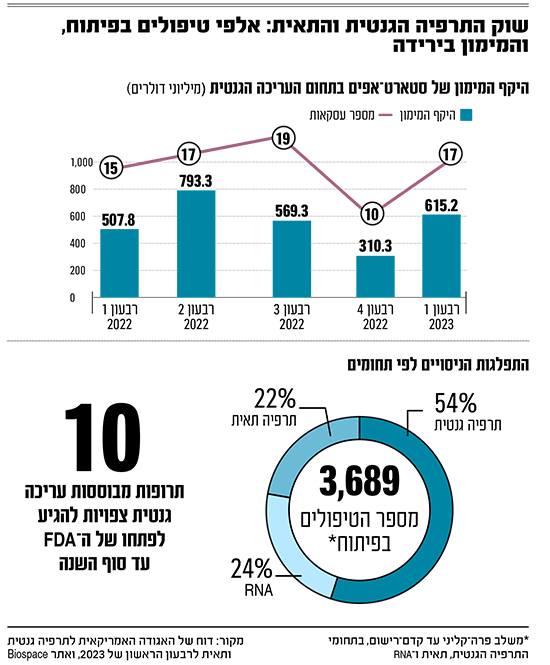
פורתאוס, פרופסור לרפואת ילדים, מנהל את תחום התרפיה הגנטית והתאית באוניברסיטת סטנפורד. הוא היה אחד המייסדים המדעיים של חברת CRISPR Therapeutics, מחלוצות התחום ואחת המתקדמות בו, שנסחרת בנאסד"ק לפי שווי של 4.3 מיליארד דולר. הוא גם ממייסדי חברת גרפיט ביו, שצלילתה לשווי של 159 מיליון דולר, לאחר שהמניה איבדה 85% משווייה בהנפקה, מדגימה חלק מהאתגרים שפורתאוס רואה היום בתחום.
לאחרונה, הוא הגיע לישראל כאורח של כנס האגודה הישראלית לריפוי תאי וגנטי שנערך באוניברסיטת בר-אילן, בחסות משרד החדשנות, המדע והטכנולוגיה, ובהובלת ד" ר איל הנדל מאוניברסיטת בר-אילן, פרופ' עדי ברזל ופרופ' דינורה פרידמן מאוניברסיטת תל אביב .
מה גרם לנפילת מניות התרפיה הגנטית והתאית בשנה וחצי האחרונות, נפילות שגררו מטה את כל תחום הביומד?
"יש כמה הסברים. הראשון, התלהבות יתר. לא הייתה באמת הפנמה של מורכבות פיתוח התרופות בתחום הזה. רעיונות מדעיים הפכו לחברות אחרי מאמר יחיד, עוד בטרם שוחזר על ידי מעבדות נוספות. זה ללא ספק מוקדם מדי".
ההסבר השני טמון באתגר הייצור. "אלה תרופות שמורכבות לייצור יותר מגלולה, חלבון בהזרקה או אפילו חיסון", הוא אומר. אבל גם זו אינה הבעיה העיקרית בעיניו. ההסבר השלישי הוא בעיה מרגיזה ומתסכלת למדי מבחינתו: הבעיה הכלכלית.
"תרפיה גנטית אמורה להינתן פעם אחת ולרפא מחלה כרונית. זה חלק ממה שמלהיב בעניין, אבל אנחנו לא יודעים איך לתמחר או איך לשווק מוצר כזה.
"המצב מסתבך משום שהמחלות הכי מתאימות לטיפול בטכנולוגיה הזאת הן לרוב מחלות נדירות. לפעמים אפילו מדובר בשוק של שניים-שלושה חולים בשנה. מלבד הצו המוסרי לרפא את החולים הללו אם אנחנו יודעים כיצד, יש לנו כחברה תמריץ נוסף: אם נצליח בפיתוח מוצרים לאינדיקציות הספציפיות האלה, נלמד אולי גם כיצד להתחיל להתמודד עם המחלות הנפוצות יותר. אז כדאי לאנושות וכדאי כלכלית לתעשיית התרופות לעשות זאת, אנחנו רק לא יודעים בדיוק איך לתרגם את הכדאי הזה למודל שמושך משקיעים כבר היום".
הפרדוקס של הצלחת הטכנולוגיה
"Orchard Therapeutics היא 'חברת הפוסטר' של הבעיה הזאת, שלא בטובתה כמובן", אומר פורתאוס. החברה עלתה לכותרות לאחר שפיתחה טכנולוגיה לטיפול ב"ילדי בועה", הסובלים מכשל חיסוני מולד. בארה"ב מדובר בפחות מעשרה ילדים בשנה.
אורצ'רד הציעה להם תרפיה תאית עם עריכה גנטית. בניסוי קליני, 48 מתוך 50 ילדים שטופלו נהנו משיפור משמעותי במצבם. הם חזרו לבית הספר, לחיי חברה תקינים, וכמו שאמר רופא בתחום בעבר ל־CNN: "אנחנו בקושי שומעים מהם, כי הם לא צריכים אותנו".
אלא שבאופן פרדוקסלי, הניסוי חיסל לחברה חלק לא זניח מהשוק. אחרי שהיא נתקלה גם באתגרים בייצור בכמות מסחרית, הודיעה החברה שהיא נוטשת את המחלה הזאת לטובת פיתוח טיפולים למחלות נפוצות יותר. הילדים שלא נכללו בניסוי וחיכו לטיפול בקוצר רוח נותרו כלואים בבית, מנותקים מהעולם וזועמים.
אורצ'רד החזירה את המוצר לאוניברסיטה שממנה לקחה אותו, UCLA, והבטיחה לעזור ככל יכולתה, כולל כספית, למצוא אפיק אחר למסחור המוצר. כ־25 ילדים מחכים היום לטיפול, והאוניברסיטה החלה לטפל בכמה מהם באופן ניסיוני. אבל הקצב שלה לא מספיק כדי לטפל במספר החולים החדשים בכל שנה.
איך מתחילים לגשת לפתרון הפרדוקס הזה?
"הלוואי שידעתי. יש כמה מחלות שהן מספיק נפוצות כדי שהעריכה הגנטית שלהן תשתלם לחברות התרופות, אבל מספיק נדירות כדי שהטיפול בכל מי שחולה בהן לא ימוטט את ביטוחי הבריאות הממשלתיים, וכנראה התחום יתחיל משם".
בטיחות? יש יותר חששות מתקלות
יש כמה סוגים של טיפולים גנטיים. אפשר לטפל בתאים של החולה מחוץ לגוף ואז להזריק אותם חזרה (כל הטיפולים שבניסוים קליניים מתקדמים הם מהסוג הזה), אבל חלום הקריספר הוא לערוך עוברים כך שלא ייוולדו מלכתחילה עם מוטציה או לתקן את הפגם הגנטי בכל התאים של אדם קיים. זה הרבה יותר מסובך וניסיוני, ולכן כל העולם היה בהלם מהניסוי של הא.
חלוקה נוספת של סוגי טיפולים היא בין פגיעה בגן קיים, שזה יחסית קל, לבין מחיקה של מקטע שגוי בגן והחלפתו במקטע תקין. זה קצת יותר מסובך, ורוב הטיפולים שבניסויים מתקדמים הם מהסוג הראשון.
מהן בעיות הבטיחות?
"חיתוך במקום הלא נכון. אבל במציאות, אם מתכננים נכון, זה כמעט לא קורה. קריספר הרבה יותר ספציפי מכפי שיכולנו לדמיין. עוד לא ראינו ניסוי קליני שהופסק משום שהעריכה הגנטית באמצעות קריספר עשתה משהו שלא הייתה אמורה לעשות".
בתי החולים בישראל מדברים על ייצור
פורתאוס מספר שבביקורו בישראל, הוא השתתף במפגש של האגודה הישראלית לתרפיה תאית, שבו דנו בשאלה אם כדאי שלבתי החולים המובילים בארץ תהיה היכולת לייצר את התאים לתרפיה גנטית אצלם. בית החולים שיבא, למשל, כבר החל לפתח יכולות כאלה, הא אומר.
"בתרופות קלאסיות, אין שום צורך שבית החולים יעשה זאת, זה בלתי סביר. אבל בתחום התרפיה התאית, אם אנחנו רוצים להפיק תאים ממטופל, לערוך אותם ולהחזיר אותם, אז כן, בהחלט שוקלים את זה. ואחד היתרונות של ישראל הוא שיש לכם את כל היכולות בכל התחומים הרלוונטיים לטיפול בתאים ערוכים גנטית, ואפשר לבחון בישראל פיילוטים של כל מיני סוגים של מערכי ייצור כאלה. הניחוש שלי הוא שבסופו של דבר הייצור יהיה מקומי, אבל לא בכל בית חולים".
מה לגבי תחום התרפיה התאית לסרטן? הוא נחשב הבטחה גדולה, אחר כך המכירות גמגמו בגלל אתגרי הייצור, ועכשיו נראה שההכנסות נוסקות שוב.
"שתי החברות המובילות בתחום הזה הן נוברטיס וגיליאד והן שמו אינסוף הון על מערכי הייצור שלהן. ההכנסות הן בהתאם, אך מה שלא ידוע לשוק הוא עד כמה המתקנים הללו יעילים. מה שיעורי הכישלון? כל כמה זמן תהליך הייצור לוקח יותר מדי זמן והחולה כבר מידרדר באופן שהטיפול לא מועיל לו? בכל מקרה, הם הוכיחו שהייצור והשיווק של מוצר כזה הם אפשריים. עכשיו האתגר הוא הנדסי, לייעל את התהליך".
ה־FDA, מנהל המזון והתרופות האמריקאי, משדר אופטימיות לגבי התחום כולו. גורמים מטעמו הודיעו השנה שהם יעשו מאמצים משמעותיים כדי לתמוך בפיתוח, בניסוי ובאישור של תרופות מבוססות על עריכה גנטית. במקביל, עובדים שם על מסגרת רגולטורית חדשה ומפורטת יותר למוצרים הללו, עם דגש על מתן תמריצים לפיתוח הטיפולים הללו למחלות נדירות ואולטרה-נדירות.
"המהלך שעשו גיליאד ונוברטיס היה מאוד חשוב לתחום. היום השוק לא מספיק חזק בשביל הרפתקאות כאלה ואין לו סבלנות, אז כנראה שהקפיצה הבאה תקרה רק כאשר שוק הביוטק הבורסאי שוב יהיה חזק. אבל גם אם מבחינה פיננסית התחום קצת תקוע, המדע ממשיך להתקדם. אנחנו בעולם המדע אוסף של אנשים עקשנים ואופטימים, ואנחנו נפצח את זה".
לתשומת לבכם: מערכת גלובס חותרת לשיח מגוון, ענייני ומכבד בהתאם ל
קוד האתי
המופיע
בדו"ח האמון
לפיו אנו פועלים. ביטויי אלימות, גזענות, הסתה או כל שיח בלתי הולם אחר מסוננים בצורה
אוטומטית ולא יפורסמו באתר.