האם תינוק אחד יצליח להציל את תעשיית העריכה הגנטית שאכזבה?
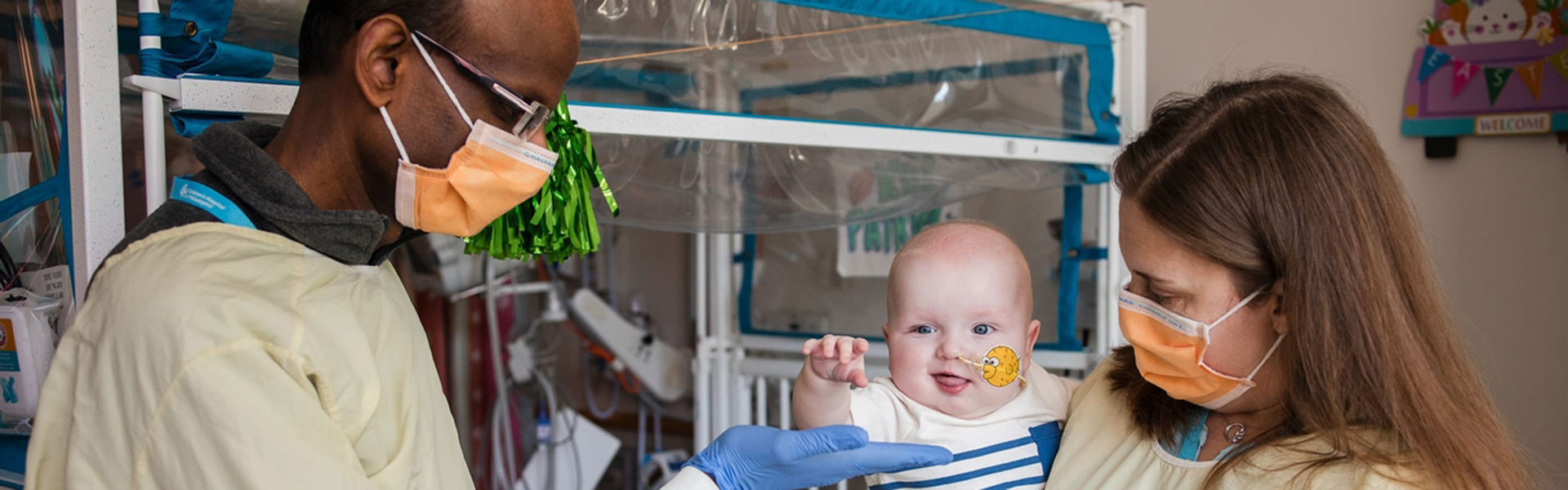
התינוק KJ שעבר טיפול בעריכה גנטית, עם החוקרים / צילום: Children's hospital of Philadelphia / News Release
קצת כמו באירוע משפחתי ישראלי בשנים האחרונות, המשתתפים בקונגרס העולמי לטיפול תאי וגנטי, שהתקיים לאחרונה, הסתובבו בין האולמות במצב רוח מתוח, מנסים להתרכז במתרחש בפנים ולהתעלם מתנאי השוק שבחוץ. הדבר היחיד שהעלה לרגע חיוך אמיתי על פניהם היה תינוק.
● ההבטחה של אסותא בדרום לקיצור תורים והשאלה הגדולה: מאיפה יגיעו הרופאים?
● ילידי 1974-1985? זו השיחה שאתם צריכים לנהל עם ההורים שלכם
KJ Muldoon היה אז בן עשרה חודשים, והעובדה שהגיע לגיל הזה לא מובנת מאליה. כשהיה בן יומיים, רופאיו שמו לב שהוא נעשה אפתי, הפסיק לאכול והתקשה לווסת טמפרטורה. בבית החולים לילדים של פילדלפיה הוא אובחן כלוקה במחלה גנטית נדירה המובילה להצטברות אמוניה בגופו. לכאורה, הפתרון היחיד עבורו היה השתלת כבד - ניתוח קשה מאוד לתינוק, ובמיוחד לתינוק במצבו, אלא שבאותו בית חולים חוקרים בשנים האחרונות בדיוק את המחלות האלה, ולרופאים היה רעיון - טיפול בעריכה גנטית.
נדרש כפר שלם לטיפול אחד
KJ חובר לדיאליזה שהחזיקה אותו בחיים באופן זמני, והרופאים והמשפחה יצאו למרוץ: בתוך יום בוצעה לו סקירה גנטית מלאה, יומיים אחר כך זוהתה המוטציה שהוא סובל ממנה. בית החולים גייס את קבוצת Danaher (דנהר), וזו החלה לייצר באמצעות טכנולוגיית העריכה הגנטית CRISPR תרופה המיועדת בדיוק למוטציה הזאת. גם ה־FDA, המפקח על טיפולים כאלה, נרתם ואישר את ההתערבות החריגה במהירות שיא.
זה אולי נשמע פשוט: אם אנחנו יודעים מה לא בסדר בגנום של התינוק, ויש לנו טכנולוגיה מוכחת המאפשרת כתיבה מחדש של DNA, הגיוני שנוכל לבצע עריכה גנטית מותאמת אישית. במציאות, מדובר באירוע מורכב ואף מסוכן. בהמשך נסביר מדוע, אבל בינתיים נאמר שהמאמץ דרש שיתוף פעולה בין רופאיו של KJ, מדעני עריכה גנטית וכמה חברות מקבוצת דנהר, שכל אחת מהן מייצרת רכיב אחר של הטכנולוגיה הדרושה לביצוע עריכה כזאת.
שיתוף הפעולה תקתק באופן מרשים. פיתוח כלי העריכה המותאם אישית ל־KJ דרש עבודה בהולה של כל הגורמים הללו במשך חודשים, והשקעה המוערכת בכמה מיליוני דולרים. הבהילות נבעה מכך שמצבו של KJ המשיך להידרדר. אם לא היה מטופל בתוך כמה חודשים, היה נגרם לו נזק בלתי הפיך.
ימים ספורים לאחר הטיפול, מצבו של KJ החל להשתפר. בהדרגה, הוא יכול היה לעכל יותר חלבון בלי שיצטברו בגופו רמות מסוכנות של אמוניה, וכתוצאה מכך הוא הצליח להעלות משקל ולגבוה. לא ניכרו תופעות לוואי של הטיפול הגנטי. היום הוא תינוק חייכן לפי הדיווחים, וגם אם הוא עדיין בטיפול רפואי ובוודאי במעקב, החיים של המשפחה חזרו להיות קרובים לנורמליים.
"הפרזנטציה של קבוצת הרופאים שניצחה על הטיפול הייתה גולת הכותרת של הכנס", אומר פרופ' איל הנדל, ראש המעבדה לעריכה גנטית ותרפיה גנטית בבר אילן. "מדהים לראות שבתוך 7־8 חודשים הגיעה הקבוצה הזאת מאבחון לטיפול בתינוק, ונראה שאכן הצליחו לשפר את מצבו. נדרש כפר שלם כדי ליצור את הטיפול הזה".
ההשקעות ירדו, פייזר נטשה
הסיפור האופטימי של KJ הגיע בעיצומה של תקופה קשה לתעשיית העריכה הגנטית. ב־2021 היה התחום הזה הכי חם בסקטור הביוטק, שהיה כולו לוהט. תרופת ה־CRISPR הראשונה אושרה ב־2023, במהלך מדהים במהירותו - 11 שנים בלבד מאז הפעם הראשונה שבה הודגמה עריכה גנטית באמצעות קריספר על ידי פרופ' ג'ניפר דודנא ופרופ' ענמואל שרפנטייה. השתיים קיבלו פרס נובל עבור הטכנולוגיה שפיתחו ב־2020.
האפשרויות נראו נגישות ובלתי מוגבלות. אולם, אתגרים מדעיים ובעיקר כלכליים, הובילו להתעוררות מדכאת מהחלום.
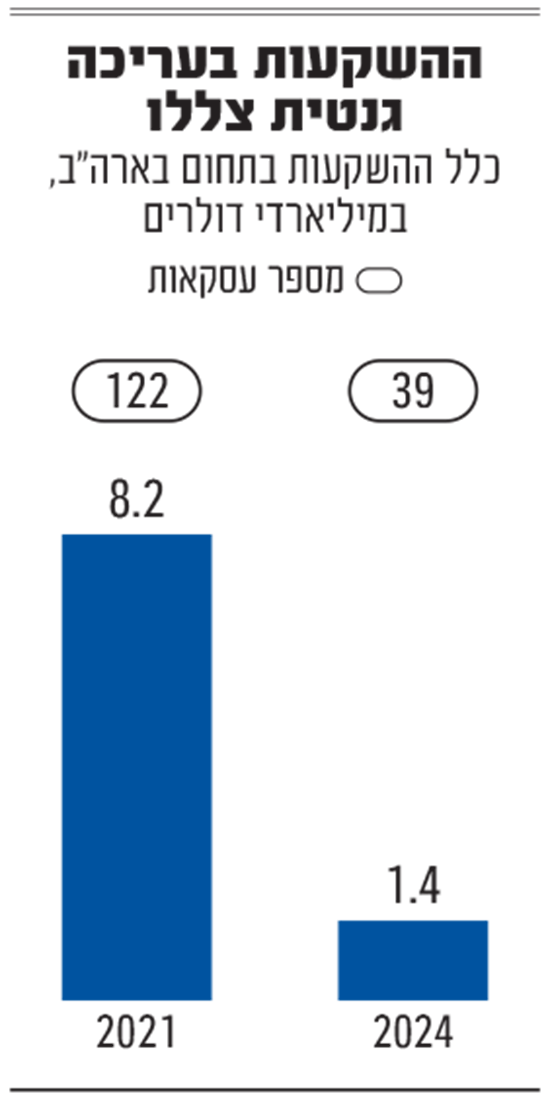
לפי נתונים שפורסמו בחודש מרץ השנה בסוכנות הידיעות רויטרס, היקף השקעות ההון־סיכון בתרפיה גנטית בארה"ב ירד דרמטית מאז 2021. באותה שנה הושקעו 8.2 מיליארד דולר ב־122 עסקאות. ב־2023 הושקעו 3.5 מיליארד דולר ב־60 עסקאות, וב־2024, המספרים כבר ירדו ל־1.4 מיליארד דולר ב־39 עסקאות. אפשר רק לנחש שלא נראה שיפור ב־2025, בהתחשב במצב בשווקים ובחוסר הוודאות הרגולטורית.
המוצר Casgevy של וורטקס, לטיפול במחלות בטא תליסמיה ואנמיה חרמשית, היה חלוץ השוק. צפו לו הכנסות של 2 מיליארד דולר בשיא, אך מאז השקתו בשנה שעברה הוא הכניס עשרות מיליוני דולרים בלבד. ההכנסות הללו אמנם צומחות, אך אימוץ הטכנולוגיה אטי מהצפוי. האשם הוא בין היתר במחיר הגבוה שננקב לטכנולוגיה כדי להצדיק את עלות הפיתוח שלה ואת העובדה שמדובר בטיפול חד־פעמי שאמור להוביל לריפוי. האם 2.2 מיליון דולר שווים את החופש ממחלה גנטית? גם אם החולים יאמרו "כן", חברות הביטוח הן אלה שיצטרכו לאשר זאת.
בפברואר האחרון, חברת פייזר הפסיקה למכור את התרפיה הגנטית שלה להמופיליה, שתומחרה ב־3.5 מיליון דולר למטופל. המוצר כבר אושר על ידי ה־FDA, אך החברה טענה שהעניין במוצר מצד מטופלים ורופאים מוגבל. פייזר משווקת תרופות אחרות להמופיליה, ונראה שהמטופלים מסתדרים איתן ולא מוכנים לשלם הון ולהסתכן בטיפול שנשמע עתידני כדי להיפטר מהבעיה אחת ולתמיד. בכתבה שפורסמה ברויטרס, רופאים הצביעו על סיבה נוספת לחוסר ההתלהבות של המטופלים: מאחר שיש רק הזדמנות אחת לבצע עריכה גנטית, הם רצו לוודא שהם מהמהרים על הטיפול הנכון וקיוו שאולי יגיע טיפול עוד יותר מתקדם בעתיד. אבל אם פייזר נטשה את המגרש, איזה תמריץ יהיה לקידום הפיתוח של טיפולים כאלה?
חברת בלובירד ביו, גם היא בין חלוצות התרפיה הגנטית, מספקת דוגמה נוספת למשבר. בשיאה, היא נסחרה ב־10 מיליארד דולר. לפני כמה שבועות החברה הסכימה להימכר תמורת מקדמה של 45 מיליון דולר ואפשרות לתשלומים נוספים "במקרה הלא סביר שהכנסות החברה יגיעו ל־600 מיליון דולר בשנה עד סוף 2027", כפי שהגדיר זאת האתר Fierce Biotech.
כמו Casgevy, גם המוצרים של בלובירד מיועדים לטיפול בבטא תליסמיה ואנמיה חרמשית, ובמחלה גנטית נדירה נוספת שגורמת לניוון במערכת העצבים.
המכה האחרונה בתחום העריכה הגנטית ניחתה רק השבוע. ה־FDA עצר ניסוי של חברת Rocket Pharmaceuticals לאחר שאחד החולים מת.
מחפשים מודל שיכניס כסף
פרופ' איל הנדל אומר שישנם עדיין ניסויים רבים בתחום העריכה הגנטית שמתנהלים כיום, הודות לכספים הנאים שהושקעו בשנים היפות, והתעשייה מחכה לתוצאות של כמה מהם כדי להבין איך להמשיך הלאה. בינתיים, פוטרו בתעשייה אלפי אנשים העוסקים בגילוי ובפיתוח של מוצרים בשלבים מוקדמים.

פרופ' איל הנדל / צילום: תמונה פרטית
התנאים בשוק לא מעודדים: הריבית הגבוהה מובילה לירידה של השקעות בסיכון; קיצוצים ב־NIH, מכון הבריאות הלאומי בארה"ב, מפחיתים את תקציבי המחקר; קיצוצים ב־FDA עלולים לעכב את אישורי התרופות או לפגוע בבניית פרוטוקולים חדשים לאישורן. ד"ר פיטר מארקס, מי שעמד בראש החטיבה שעסקה בנושא הזה ושאף מאוד לקדם את התרפיות הגנטיות לכל מטופל, התפוטר מתפקידו בעקבות מחלוקת בנושא החיסונים, תחום אחר שהופקד עליו. הראש הנכנס, ד"ר וויניי פרסד, כבר הביע ביקורת על חלק מההקלות שמארקס נתן לחברות תרפיה גנטית.
"הסביבה בביומד מאוד מורכבת", אומר רום קשוק, שהקים לאחרונה עם הנדל חברה ששואפת לפתור חלק מהבעיות בתחום בעזרת שילוב של מודלי שפה גדולים (LLMs) עם מידע ביולוגי ניסויי המיוצר בחברה.
"התעשייה עובדת מול רוח נגדית מאוד חזקה בגלל סביבת המקרו. התעשייה גם לא בשלה, וחברות הפארמה הגדולות, גם הן אמרו בכנס לחברות הצעירות יותר - בואו תראו לנו איך אתם פותרים בעיות שאפשר לעשות מהן כסף, ואז נקנה אתכן. התרופות שהגיעו עד עכשיו לשוק מתומחרות יקר, ויש להן מעט לקוחות. התחום התחיל מטיפול במחלות של גן אחד, ובאמת קל יותר להוכיח בהן היתכנות, אבל תעשיית הפארמה מכירה שוק במחלות של חצי מיליון חולים. כמה מחלות של גן אחד הן כאלה?".
מכל הסיבות הללו, התעשייה תולה כל כך הרבה תקוות בסיפור של התינוק KJ. "כיום, כדי לבצע טיפול עריכה גנטית בחולים, יש לזהות מחלה שהיא נפוצה מספיק, והמוטציות של החולים דומות מספיק זו לזו, כדי שיהיה כדאי לצאת למסע של שנים ומיליארדי דולרים, לערוך את כל תהליך הפיתוח ואת הניסויים הקליניים המפרכים", מסביר הנדל. "אך מה אם היינו יכולים לקבל את אישור השיווק לא עבור כל תרופה בנפרד, אלא עבור ה'מתכון', עצם תהליך העריכה, כאשר לכל חולה עורכים את המוטציה האישית שלו ללא צורך לבצע בכל פעם ניסויים נוספים?". במקרה כזה, השוק לכל "תרופה" היה מתרחב ואפשר היה להגיע פוטנציאלית לכסף גדול, בלי להשקיע בכל מחלה בנפרד. אולי כך אפשר גם, עם הזמן, להוריד את המחיר עבור הטיפול בכל חולה ולבצע טיפולים ספציפיים יותר וטובים יותר.
על פניו, גישה כזו גם תאפשר להגיע במהירות הנדרשת לחולים שהכי זקוקים לטיפול: תינוקות שנולדו עם פגם גנטי ברור ועלולים למות בתוך חודשים או שנים ספורות ללא התערבות. בשוק זה, השיווק עשוי להיות קל יותר מאשר מול חולים בהמופיליה או באנמיה חרמשית, שמסתדרים גם בלעדיה.
"מהפכה מדעית ורפואית"
זו התקווה, אבל יש גם חסמים רבים, אומר פרופ' אורי בן דוד, חוקר גנטיקה של סרטן בפקולטה למדעי הרפואה והבריאות ע"ש גריי באוניברסיטת תל אביב. אבל קודם כול הוא מבקש שנהיה אופטימיים. "כמו שלקח לנו זמן באמת לקרוא את הגנום באופן אפקטיבי, כך עכשיו אנחנו לומדים בהדרגה לכתוב אותו", הוא אומר. "מיד כשהקריספר יצא לעולם ככלי לעריכה גנטית של בני אדם, היה ברור שזו מהפכה לא רק מדעית אלא גם רפואית עצומה. בשנתיים וחצי האחרונות, החלום מתגשם ותרופות קיבלו אישור וניתנות לחולים. זו הוכחת היתכנות יפה שמראה שהמהפכה כבר קרתה, ואין דרך חזרה".

פרופ' אורי בן דוד / צילום: שרון גבאי, הקרן לחקר הסרטן בישראל
ההתפתחויות המדעיות אכן לא מפסיקות להגיע. בן דוד מציין כי KJ טופל בדור החדש של הקריספר, טכנולוגיה שנקראת Base Editing. במקום לחתוך את גדיל ה־DNA לרוחבו, ניתן בטכנולוגיה זו לקצץ כל בסיס ספציפי בקצה שלו ולהחליפו בבסיס אחר. אם נדמיין את ה־DNA כספר ההוראות של הגוף, הרי שמדובר ל א בטכנולוגיה שבה גוזרים החוצה משפט בעמוד ומחליפים אותו במשפט אחר, אלא בטיפקס, שינוי של אות פה ואות שם. זו אמורה להיות עריכה עם יותר ודאות ופחות סיכון.
"כרגע אי־אפשר לעשות סקייל אפ למה שנעשה ב־KJ", אומר בן דוד. "זה היה מאמץ הירואי מדעי שלא ניתן לחזור עליו באופן שבו תעשיית הפארמה עובדת היום".
מדוע יותר קשה לראות איך עובד כאן "חוק מור", שאומר שטכנולוגיות דינן להשתפר בעוד מחירן יורד?
בן דוד: "בגלל הצורך בהתאמה אישית, וסנתוז רצפי ה־DNA עבור כל חולה וחולה. אנחנו היום לא יודעים מה כל רצף עושה. אם אני עכשיו עורך מוטציה שלא הכרתי קודם, אני לא יודע מה תהיה היעילות של העריכה שלי, אני לא יודע מה הבטיחות שלה".
כבר הודגם, בין היתר על ידי בן דוד עצמו, שעריכה שאינה ספציפית מספיק יכולה להוביל לשינויים כרומוזומליים לא רצויים, והחשש הוא כי אלה יגרמו לסרטן. "יכול להיות שנגלה שהרבה עריכות כאלה הן יעילות ובטוחות", מדגיש בן דוד, "אבל כרגע אנחנו עדיין לא יודעים את זה".
ישנה גם השאלה כיצד להוליך את רצף ה־DNA אל המקום שבו אנחנו רוצים לבצע את העריכה. "אמצעי ההולכה צריך להיות ספציפי למשימה", אומר הנדל. "יש מגוון שיטות הולכה וצריך להבין איזו מהן תיתן את היעילות המקסימלית, עם דיוק ובטיחות. זהו תחום מדעי שלם שעדיין צריך להתפתח".
"כשמפתחים טכנולוגיה כזאת, אף פעם לא יודעים כמה תאים נצליח לערוך, וגם לא אם נערוך בטעות תאים שלא התכוונו לגעת בהם", מוסיף בן דוד. לצד זה יש גם סוגיות של תגובה חיסונית, שיכולות לפגוע ביעילות הטיפול ובבטיחותו.
פתרון לא רק למחלות נדירות
כיום ישנן שיטות הולכה טובות אל העור, אל הכבד ואל העין, אבל לא אל רוב האיברים האחרים, ובמיוחד קשה להוליך את התרפיה הגנטית אל המוח, שבו מתרחשת הפגיעה הכי קשה בחלק מהמחלות הנדירות של ילודים.
מה אם היינו יכולים לבנות מודל שינבא מראש את ההשפעה של כל שינוי גנטי?
בן דוד: "העולם בהחלט הולך לכיוון הזה, אבל כל כך רחוק עדיין מהפתרון. גם כאשר אנחנו מטפלים במולקולה קטנה, פשוטה יחסית, אנחנו לא יודעים באמת לנבא מה היא תעשה בגוף, ולכן דרושים עדיין ניסויים בבעלי חיים ובבני אדם, אז על אחת כמה וכמה בהתערבות בסיסית כזו. גם את הטיפול שניתן ל־KJ ניסו תחילה על בעלי חיים".
בעלי חיים הם מודלים טובים למחלות הללו?
בן דוד: "תלוי. יש גנים מאוד שמורים בין בעלי חיים מסוימים לבני אדם, ואחרים שמורים פחות, או שהגן דומה אבל המערכת בגוף שבה הוא בא לידי ביטוי שונה מאוד".
קשוק: "עוד לפני שאפשר יהיה לדבר על רפואה גנטית מותאמת אישית, התעשייה צריכה להבשיל את המוצר. התהליכים צריכים להיות יותר אחידים, הדירים, והתוצאות צריכות להיות יותר צפויות".
בן דוד: "אסור לנו להגיע למצב שבו בשל סיכונים תיאורטיים לא נציל חיים ממשיים. הלקוחות של העריכה הגנטית הם לא האוכלוסייה הבריאה, אלא תינוקות שימותו בוודאות עוד חצי שנה או חולי סרטן שיש להם כמה חודשי חיים. צריך לבחון את הדברים הללו בלי היסטריה, על פי שיקולי עלות־תועלת".
הנדל מאמין שההתקדמויות המדעיות בגנטיקה, בבינה מלאכותית ובטכנולוגיות ליצירת "איברונים" זעירים במעבדה שניתן יהיה לנסות עליהם את הטיפולים יובילו יחדיו לפריצות דרך בתחום העריכה הגנטית בקרוב. ולדבריו זה צריך לעניין לא רק את מי שיש לו או לילדיו מחלה גנטית נדירה. "המטרה היא שהיום נטפל בגנום עבור המחלות הללו, ובהמשך עבור כולן", הוא אומר.
למגוון מחלות יש גורמי סיכון גנטיים, ביניהן סרטן, מחלות מטבוליות כמו השמנה וסוכרת, מחלות אוטואימוניות, מחלות ניווניות כמו אלצהיימר ופרקינסון וגם מחלות פסיכיאטריות, כמו מאניה־דיפרסיה או סכיזופרניה. השאלה אם לבצע עריכה גנטית באנשים כדי להתמודד עם המצבים הללו היא שאלה אתית מורכבת, אבל מבחינה מדעית ועסקית, הפענוח שמתבצע כעת עבור המחלות הנדירות צפוי לפתוח את הדלת גם למחלות נפוצות ומורכבות יותר.